30 Jahre Patientenservice für Deutschland
Homecare und mehr
Die GHD GesundHeits GmbH Deutschland ist ein ambulantes medizinisches Versorgungsunternehmen.
Seit 1992 betreuen wir Patienten und institutionelle Kunden deutschlandweit mit Hilfs- und Arzneimitteln sowie umfangreichen Serviceleistungen.
Persönlich, kompetent und zuverlässig.

GHD – 30 Jahre Kompetenz
GHD – 30 Jahre Kompetenz

Was ist Homecare?
Homecare ergänzt durch die Leistung der Homecare Manager die fachpflegerische Versorgung zu Hause, in einer Pflegeeinrichtung oder durch einen Pflegedienst.
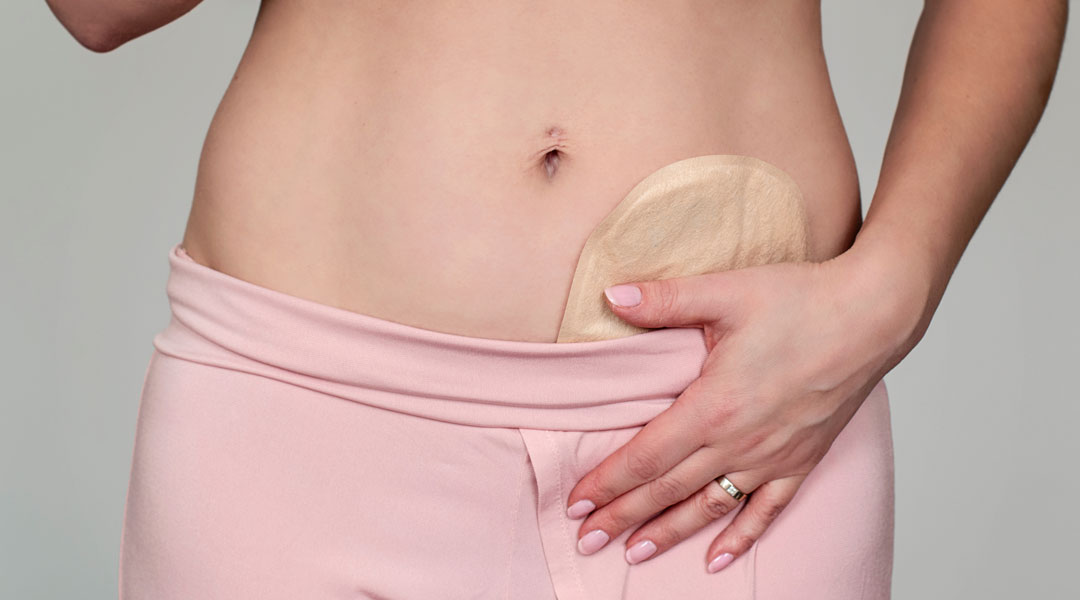
Die Leistung umfasst die eigenständige Anwendungsschulung und Lieferung beratungsintensiver medizinischer Produkte wie z. B. Produkte zur medizinischen Ernährung, zur Stoma- oder Wundversorgung.
Ziel ist es, den Menschen ein Höchstmaß an Komfort und Lebensqualität zu bieten, indem der Homecare Manager professionelle Unterstützung, Beratung und die benötigten medizinischen Hilfsmittel direkt nach Hause bringt bzw. die Belieferung sicherstellt.
Ebenso stellt der Homecare Manager die Vernetzung und Kommunikation aller an der Versorgung des Patienten beteiligten Personen und Institutionen sowie der Krankenkasse oder der privaten Krankenversicherung her und leitet Patienten mit den spezifischen Produktversorgungen vom Krankenhaus in die ambulante Versorgung über.
Diese Dienstleistungen sind ergänzend zu pflegerischer oder sozialdienstlicher Betreuung zu sehen und nicht mit einer ambulanten Pflege oder der Betreuung in einer Pflegeeinrichtung zu verwechseln.
Finden Sie Ihre passende Homecareversorgung
Der Homecare-Bereich ist vielfältig. Die individuelle Anpassung der Therapie ist entscheidend für den Erfolg. Denn die Versorgung eines Stomas erfordert beispielsweise einen anderen Einsatz des Homecare-Managers als die Therapie einer Inkontinenz. Weiterführende Informationen zu unseren Homecare-Therapiebereichen erhalten Sie hier:
GHD-Patientenservice - Optimale Versorgung und Unterstützung
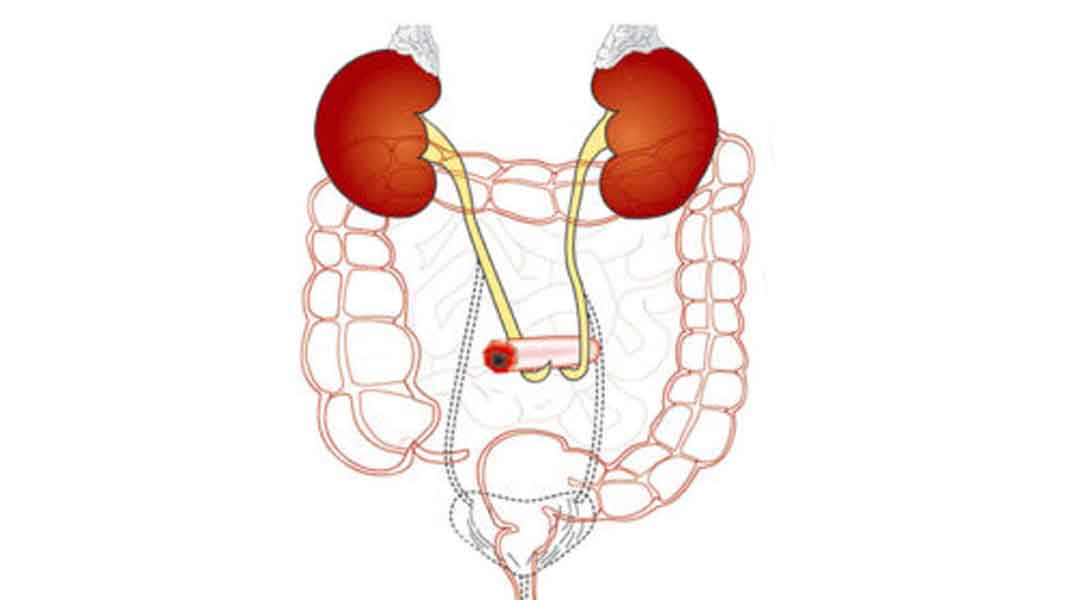
Ob Stoma, Inkontinenz, Wunde, enterale oder parenterale Ernährung – unsere Homecare-Spezialisten stellen die Hilfsmittelversorgung in Absprache mit dem Patienten und dem Arzt für einen optimalen Therapieverlauf sicher. Erfahren Sie mehr über unsere Expertise und unseren ganzheitlichen Versorgungsansatz im Bereich „GHD-Patientenservice“.
Hier haben wir für Patienten und Angehörige ein umfassendes Informationsangebot zu allen Therapiebereichen zusammengestellt. Im Fokus: Die Unterstützung für ein selbstbestimmtes Leben trotz Erkrankung.
Zum Patientenservice
Maßgeschneiderte Lösungen für Praxen, Kliniken und Pflegeeinrichtungen
Innovative Lösungen für eine effiziente und qualitativ hochwertige Gesundheitsversorgung
In einer Zeit, in der das Gesundheitswesen immer komplexer wird und der Bedarf an erstklassiger Patientenversorgung kontinuierlich steigt, sind unsere Lösungen darauf ausgerichtet, Praxen, Kliniken und Pflegeeinrichtungen dabei zu unterstützen, den sich wandelnden Anforderungen des Gesundheitswesens gerecht zu werden.
Durch unsere langjährige Erfahrung und unser tiefes Verständnis für die Bedürfnisse des Gesundheitssektors haben wir innovative Lösungen entwickelt, die speziell auf die Anforderungen von Praxen, Kliniken und Pflegeeinrichtungen zugeschnitten sind.

Finden Sie Ihr passendes Angebot
Wir sind davon überzeugt, dass unsere Lösungen Ihnen helfen werden, Ihre Arbeitsprozesse zu optimieren, die Qualität der Versorgung zu verbessern und letztendlich eine höhere Patientenzufriedenheit zu erreichen. Unsere Produkte und Services sind darauf ausgerichtet, Ihre Arbeit zu erleichtern und Ihnen die Möglichkeit zu geben, sich auf das zu konzentrieren, was wirklich zählt: die Gesundheit und das Wohlergehen Ihrer Patienten.
Wir bedanken uns für Ihr Vertrauen in die GHD GesundHeits GmbH Deutschland und freuen uns darauf, gemeinsam mit Ihnen die Zukunft des Gesundheitswesens zu gestalten.
Sie sehen gerade einen Platzhalterinhalt von Yumpu. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenWillkommen bei der GHD GesundHeits GmbH Deutschland – Ihrem Partner für ganzheitliche Gesundheitslösungen. Mit über 2.500 engagierten Mitarbeitern, einer breiten Palette an qualitativen Produkten und Dienstleistungen sowie einer ausgeprägten Dienstleistungsorientierung setzen wir neue Maßstäbe in der Patienten- und Kundenbetreuung.
Unsere Expertise erstreckt sich von Homecare und Arzneimittelversorgung bis zu Mobilitäts- und Rehalösungen, wobei die Zufriedenheit unserer Patienten und Mitarbeiter im Mittelpunkt steht. Entdecken Sie mit uns die Vielfalt und Qualität der Gesundheitsversorgung, die wir bundesweit und über die Grenzen hinaus anbieten.
Online-Visite

Für Fachpersonal haben wir die Online-Visite eingerichtet – hier arbeiten wir eng mit Pflege- und Partnereinrichtungen zusammen. Die Videovisite kommt in den verschiedensten Therapiefeldern zum Einsatz, besonders im Bereich der Wundversorgung.
Der Live-Austausch mit unseren Experten bietet eine geschützte digitale Umgebung für Fallbesprechungen und erlaubt, dass Dateien während der Online-Visite zur Verfügung gestellt werden können.
Möchten Sie mehr über unsere Online-Visite erfahren, klicken Sie hier:

Karriere bei der GHD
Als Nachversorger haben wir den längsten Patientenkontakt im gesamten Gesundheitswesen. Wir lernen die Menschen hinter den Patienten wirklich kennen und sind teilweise über Jahre an ihrer Seite.
Ob Vertrieb, Logistik, Produktion, IT, Finanzen, HR, Marketing oder einer unserer anderen diversen Bereiche: Bei der GHD ist jeder Teil des großen Ganzen. Wir ermöglichen unseren Patienten eine Zukunft mit mehr Lebensqualität.
Werde Teil des GHD-Teams!
„Durch den individuellen und richtigen Einsatz der zur Verfügung stehenden Hilfsmittel kann jeder Patient ein großes Stück Lebensqualität und Normalität zurückgewinnen. In diesen Dienst stelle ich meine Fachkompetenz.“

„Wir agieren visionär und menschlich. Wählen Sie uns als Partner und sichern sich zufriedene Kunden.“

“Täglich kann ich zur Genesung und zum Wohlbefinden von Menschen beitragen. Ich liebe, was ich tue, und ich tue es mit Leidenschaft. Aus eigener Erfahrung weiß ich, wie schnell eine schlimme Diagnose das Leben verändern kann. Anderen bei der Auswahl des richtigen Hilfsmittels zu helfen, erfüllt mich mit Freude.”































Veranstaltungen


22767 Hamburg

99095 Erfurt-Stotternheim


01309 Dresden


18437 Stralsund
99095 Erfurt-Stotternheim









0800 - 51 67 110 Rufen Sie uns an